酸・塩基のpH計算についての解説記事です。
pHの定義から強酸・強塩基、弱酸・弱塩基のpH計算まで解説します。
関連記事として例題も載せておきますので、合わせて解くことでより理解が深まるかと思います。
よろしければ最後までご覧ください。
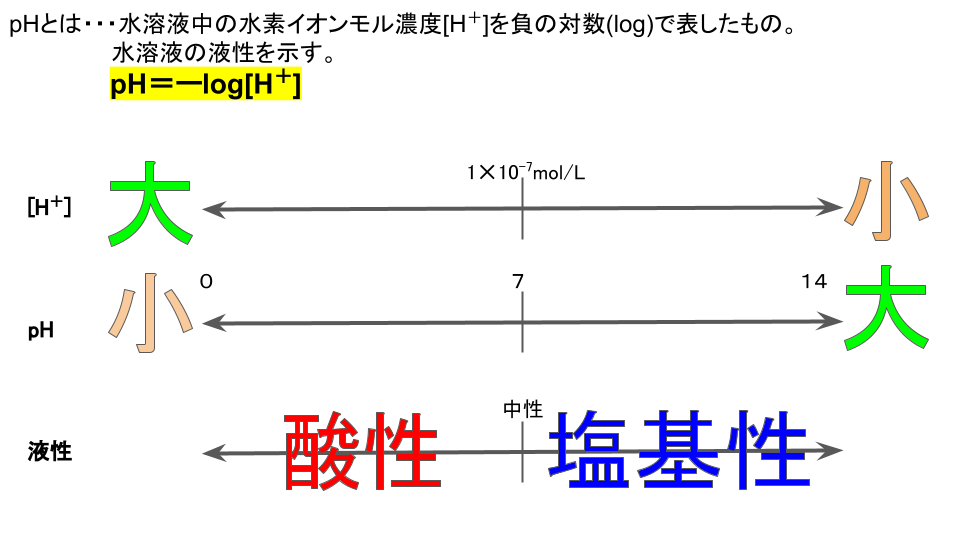
pHとは水溶液中の水素イオンモル濃度[H+]の負の対数(−log)で表される数字です。
水溶液の液性(酸性・中性・塩基性)を表します。
強酸・強塩基の計算はとてもシンプルです。
なので、公式さえ覚えておけばすぐに解くことができます。
以下に例題と公式を載せておきます。
 強酸のpH計算
強酸のpH計算 
強酸、強塩基の場合は試験レベルでは電離度α=1と覚えておいて差し支えありません。
問題に提示されていることが多いですけどね。
こちらは強酸・強塩基の時と異なり電離度α=1ではないので少し複雑になります。
ですが、こちらも公式を覚え、計算の流れさえ理解出来れば難しいものではありません。
使用する公式は上に示したものと同じです。
強酸・強塩基のときと異なるのは電離度αのみです。
弱酸・弱塩基の電離度についても問題中に提示されていることが多いので基本的には覚える必要はないです。
以下、例題です。
 弱酸のpH計算
弱酸のpH計算 次に、希釈溶液のpH計算です。
こちらは前2つに比べるともう少し複雑になります。

今までの例題では予めモル濃度がわかっていましたが、希釈溶液の問題では自分でモル濃度を求めなければいけません。
モル濃度さえわかってしまえばあとは公式に当てはめてpHを導き出すだけになります。
以下、例題です。
 希釈溶液のpH計算
希釈溶液のpH計算 最後に酸と塩基を混ぜた混合溶液のpHの計算です。
最も複雑になりますが、ここまでの公式や考え方を理解できていれば問題なく解くことができるはずです。

以下、例題です。
 混合溶液のpH計算
混合溶液のpH計算 酸・塩基のpH計算について、シンプルなものから順に解説しました。
覚えておくべきことは以下の通りです。




ちなみにモルやモル濃度を求めるのが苦手な方は数字ではなく単位の方をみるのがおすすめです。

このように求めたい単位に対応する数字を当てはめるだけで求められるので計算がぐっとしやすくなります。

